Здравствуйте, уважаемые читатели блога zdoroviedam.ru
Антиоксиданты и свободные радикалы — важная тема разговоров о здоровье. И только специалисты понимают механизм их действий. Читайте в статье популярно об этом.
Я решил написать статью на эту тему по трем причинам.
Во-первых, статья Основы здорового питания, которую разместил накануне, напрямую перекликается с данной записью.
Во-вторых, я верен своему обещанию (см.здесь), освещая тот или иной вопрос по здоровью, объяснять суть процессов, происходящих в организме.
В-третьих, имея профильное высшее образование (Военная Краснознаменная Академия химической защиты) могу с понятием об этом рассказать.
Фото, которое выше, попало сюда не случайно. Овощи и фрукты, которые на фото, содержат различные антиоксиданты
Начнем с того, что антиоксиданты необходимы для нейтрализации воздействия на организм свободных радикалов.
Чтобы понять — небольшое отступление. Давайте разберемся, что свободные радикалы из себя представляют.
У каждого на слуху такие понятия, как кислород, хлор, водород, другие названия из таблицы Менделеева. Это химические элементы. Каждый элемент состоит из совокупности атомов одноименного названия.
При соединении (химических реакциях) разных элементов образуются химические соединения. Химический элемент натрий (Na), соединяясь с химическим элементом хлор (Cl), образует химическое соединение хлористый натрий (NaCl) – общеизвестная пищевая соль.
Любые химические элементы состоят из наименьших в природе универсальных частиц – атомов. Частицы потому универсальны, что отличаются ядром (его весом, зарядом) и количеством электронов около ядра.
Теперь про ядро. Оно состоит из протонов и нейтронов, которые в совокупности определяют массу ядра (массу атома).
Протоны и нейтроны имеют одинаковую массу. Протон положительно заряжен, нейтроны — нейтральны. Количество электронов (имеют отрицательный заряд) около любого ядра равно количеству протонов в ядре (положительному заряду ядра).
В качестве примера рассмотрим упомянутый натрий. Масса его ядра (атома) составляет 23 атомные частицы массы. В том числе, 12 нейтронов и 11 протонов. Количество электронов соответствует количеству протонов – 11.
Получается, атом нейтрален – 11 положительно заряженных протонов нейтрализуются отрицательно заряженными электронами, их тоже 11.
Аналогичная картина, но с разными количествами нейтронов, протонов и электронов, у других элементов.
Пример: в ядре атома кальция содержится 20 нейтронов, 20 протонов и около ядра 20 электронов.
Другой интересный вопрос – каково пространственное размещение электронов около ядра. Ученые мужи считают, они находятся не в одной кучке, а на различных энергетических орбитах. Количество орбит зависит от количества электронов.
По законам физики распределение электронов по орбитам таково:
- — первая энергетическая орбита должна иметь 2 электрона;
- — вторая, третья, четвертая и далее — по 8 электронов;
- — на последней (внешней) орбите размещаются оставшиеся, после укомплектования предыдущих орбит, электроны.
-
группа “Витаминов”. В частности, витамины Е, А, С и В. Витамины А и Е жирорастворимые, витамины С и группы В – водорастворимые.
Роли защитников у них отличаются — водорастворимые защищают стенки сосудов, различные связки и мышцы, жирорастворимые защищают жировую ткань.
-
группа “Биофлаваноидов”. В настоящее время известно около 4-х тысяч различных флаваноидов. Они не вырабатываются в организме и могут поступать в него только с пищей.
Биофлаваноидами называют группу особых соединений, которые находятся в красном вине, цитрусовых (апельсин, грейпфрут, лайм, лимон, мандарин, помело и другая экзотика), зеленом чае, какао и кофе. К сожалению, в России растут только мандарины.
- группа растительных пигментов: в виде ликопина, лютеина и антоциана. Эти ферменты находятся в овощах и фруктах красного, синего и желтого цвета.
-
еще одна группа веществ, которую относят к антиоксидантам, это макро и микроэлементы.
В первую очередь селен, цинк, кальций.
Больше всего селена (в 100 граммах продукта) содержат: сушеные белые грибы – около 100 мкг, чеснок – до 40 мкг, брынза – до 25 мкг, селедка – до 20 мкг, гречка – до 14 мкг. Суточная норма селена от 70 мкг.
Чемпионы по содержанию цинка в 100 граммах продукта: устрицы – от 15 мг, тыквенные и арбузные семечки – до 10 мг, нежирная говядина – до 11 мг, печень теленка – до 12 мг. Суточная норма цинка для взрослых 10-15 мг.
Суточная норма кальция для взрослых – 1000 мг.
Посмотрим, распределение электронов атома натрия (о нем говорили выше) по указанной теории. Всего 11 электронов. Распределение следующее: на первой энергетической орбите – 2 электрона, второй орбите — 8, третьей (внешней) – 1 электрон. Схема: 2-8-1.
Атом кальция (Ca), мы говорили, имеет 20 электронов. Значит, орбит четыре, а не три, как у натрия. Распределение по энергетическим орбитам выглядит так: 2-8-8-2. Думаю, понятно.
Изложенные выше законы физики относятся ко всем, существующим в природе элементам (атомам), кроме атома водорода (обозначается английской «Н»). Его ядро состоит из одного протона и, следовательно, около ядра находится один электрон.
С энергетическими орбитами разобрались.
Далее разберемся с понятием устойчивости .
В химии существует понятие устойчивости (устойчивого состояния) атомов и молекул. Устойчивое, неустойчивое состояние зависит от распределения электронов на энергетических орбитах.
Если около ядра одна энергетическая орбита (такая только у водорода), то условие устойчивого состояния — нахождение на орбите 2-х электронов. Ниже рассмотрим, как подобное возможно.
Если энергетических орбит больше одной, то условие устойчивости – нахождение на первой энергетической орбите 2-х электронов, на остальных (второй, третье, четвертой ….) — по 8 электронов.
Уважаемые читатели, проанализировав количество электронов около ядра атома любого химического элемента (по примеру натрия и кальция), вы убедитесь, все атомы, не вступившие во взаимодействие с другими атомами, находятся в неустойчивом состоянии .
Например, атом калий (обозначается «К») имеет четыре орбиты. На первой орбите 2 электрона (как у других существующих атомов, кроме водорода), на второй, третьей по 8 электронов, четвертой орбите 1 электрон. Всего 19 электронов. Данное состояние атома неустойчивое. Для устойчивости не хватает 7-ми электронов.
Будь у калия 20 электронов, то он превратился бы в кальций (Ca). Электроны в таком случае распределяются по орбитам в соотношении 2-8-8-2. Тоже неустойчивое состояние. До устойчивости не хватает 6-ти электронов.
Изложенное выше принципиально важно! Это позволит понять суть действия антиоксидантов, о которых так много говорят.
Обычно атомы любых элементов переходят в устойчивое состояние, вступая во взаимодействие с подобными себе или атомами других элементов. В обоих случаях образуются молекулы.
Разберем два примера.
Первый пример. Атом водорода на орбите имеет один электрон. Это состояние неустойчивое. Чтобы атому водорода стать устойчивым, он взаимодействует (соединяется) с таким же, как он, атомом, образует молекулу водорода Н2.
В этой молекуле на первой (она же внешняя) энергетической орбите взаимодействующих атомов оказываются 2 электрона. Они находятся в совместном пользовании. По одному от каждого атома.
В результате положение атомов в молекуле стало устойчивым.
Другой пример – атом хлора. Обозначается буквами “Cl”.Около ядра обращаются 17 электронов. 2 электрона – на первой энергетической орбите. 8 электронов – на второй орбите, оставшиеся 7 электронов – на третьей (внешней орбите).
Чтобы стать устойчивым атом хлора должен вступить во взаимодействие с каким-либо другим атомом, чтобы на внешней орбите у него стало не 7, а 8 электронов.
Приведу два примера такой возможности.
Первый пример, атом хлора (Cl) взаимодействует с таким же, как он атомом. Мы помним, что на внешней энергетической орбите у атомов по 7 электронов. Атомам не хватает для устойчивого состояния по 1-му электрону. В данном конкретном случае оба атома так «сближаются», что 2 электрона (по одному от каждого атома) поступают в общее пользование.
Получается, каждый атом из 7-ми, имеющихся на внешней орбите, электронов отдал в общее пользование по 1-му электрону и оставил себе по 6 электронов. В результате подобной “взаимопомощи” в общем пользовании оказалось 2 электрона.
В итоге, каждый атом на внешней орбите имеет по 8 электронов (6 оставшихся своих плюс 2 общих) и эта форма устойчивого состояния обоих атомов и молекулы хлора (Cl2).
Второй пример, молекула соляной кислоты НCl (соединение атомов водорода и хлора). Кстати, соляной кислоте HCl принадлежит одна из основных ролей в пищеварении. Она совместно с ферментами и слизью образует желудочный сок.
На фоне предыдущего примера, здесь объясню короче. Повторю, у атома хлора, из имеющихся 17 электронов, на внешней орбите находятся 7 электронов. У атома водорода на первой (она же внешняя) орбите 1 электрон.
При образовании молекулы соляной кислоты водород отдает в общее пользование 1 электрон. Атом хлора предоставляет в общее пользование тоже 1 электрон, находящийся на внешней орбите.
В результате у атома водорода на первом энергетическом уровне становится 2 электрона (один свой и один от хлора — устойчивое состояние). Атом хлора за счет электрона от атома водорода, отданного в общее пользование, имеет 8 электронов на внешнем энергетическом уровне (оставшиеся 6 своих + 1 свой, находящийся в общем пользовании + 1 предоставленный в общее пользование атомом водорода — тоже устойчивое состояние).
Абсолютно аналогичная картина с распределением электронов по энергетическим уровням у всех устойчивых химических соединений, образующих и живые клетки органов организма.
Только в таком устойчивом состоянии химических соединений, образующих живые клетки органов, они (клетки) могут эффективно выполнять в организме свои, установленные природой, физиологические функции, не внося разлад (сбой) в общий жизненный процесс.
Теперь важное – если по какой-то причине любое устойчивое химическое соединение, участвующее в формировании живой клетки органа человека (печень, почки, сосуды, суставы и др), потеряет (или у него заберут) один электрон с внешней энергетической орбиты, то оно (химическое соединение) становится неустойчивым и разрушает слаженную работу клеток данного органа. Чем больше случаев потерь электронов, тем большее количество клеток будет разрушено, тем серьезнее болезнь органа или любой другой системы в организме.
Еще одно важное понятие – свободный радикал (или свободные радикалы – множественное число). Это понятие относится также к химическим соединениям (молекулам) у которых из-за потери электрона разорвалась электронная связь с одним из атомов. В результате этому соединению не хватает одного электрона, чтобы он вернулся в устойчивое состояние.
Откуда берутся такие свободные радикалы? Они образуются в самом организме как сопутствующий продукт работы самих клеток, а также в результате естественных процессов жизнедеятельности в организме.
Другими причинами усиленного образования свободных радикалов являются:
— превышение допустимых норм загрязнения воздуха радиацией и вредными веществами;
— злоупотребление спиртным и куревом;
— стресс;
— чрезмерная физическая нагрузка и чрезмерное утомление.
В период отсутствия недостающего электрона, находясь в неустойчивом состоянии, свободные радикалы ведут себя очень агрессивно. Настолько агрессивно, что могут оторвать недостающий электрон у другого химического соединения. Например, у атома, который находится в структуре живых клеток любого органа или ДНК (дезоксирибонуклеиновая кислота) — строительного кирпичика жизни .
Результатом агрессивных действий свободных радикалов на клетки организма являются серьезные проблемы с сердцем и сосудами, позвоночником и суставами, пищеварительной, мочеполовой и иммунной системами организма. К этому перечню можно добавить старение и онкологию.
Можно ли защититься от этих напастей? Можно! Для этого агрессивным свободным радикалам, которые образуются в нашем организме, вместо живых клеток наших органов надо “подсунуть” другие химические соединения. Эти химические соединения объединены общим понятием “антиоксиданты”.
Придется сделать еще одно отступление касательно слова “антиоксиданты”. Почему эти соединения получили такое название. Термин, пожалуй, чисто с химическим смыслом. Поэтому равнозначный термин “антиокислители” тоже точно передает их назначение.
Дело в том, что химические реакции, связанные с отрывом электрона одним (назовем его первым) веществом от другого (второго) вещества называются окислительно-восстановительными. При этом, то вещество (в нашем примере первое), которое отрывает электрон для себя, восстанавливается. А другое вещество (оно пострадавшее), которое отдает электрон, окисляется.
В последнем примере:
— первое вещество и есть свободный радикал. У него не хватало одного электрона. О понятии свободный радикал и их вреде я писал выше. Свободные радикалы можно назвать еще “оксидантами” поскольку они окисляют те вещества, у кого забрали электрон.
— второе вещество, которое окисляется, является пострадавшим. Этими пострадавшими выступают клетки тех органов и систем организма, о которых выше тоже сказано. Эти органы и системы организма заболевают. Иными словами, окисление веществ живых клеток какого-либо органа организма свободными радикалами приводит этот орган к болезни или гибели.
Теперь самое время вернуться к антиоксидантам (“антиокислителям”). Каким образом они защищают наш организм от свободных радикалов, что равнозначно – от болезней. Что антиоксиданты из себя представляют, где их искать.
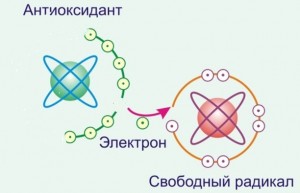
Схема защиты живых клеток организма от свободных радикалов с помощью антиоксидантов очень проста.
Представьте следующую ситуацию. В одной компании рядом находятся три персоны: свободный радикал, живая клетка какого-либо органа, ждущего атаку свободного радикала и антиоксидант (пока без имени), который тоже хорошая цель для атаки.
Законы химии таковы, что атаке свободного радикала подвергнется антиоксидант, а не живая клетка. Упрощенно это объясняется следующим – свободному радикалу легче (по затрате энергии) захватить недостающий электрон у антиоксиданта (окислить его), чем у живой клетки.
Можно сказать по-другому. Антиоксидант очень легко (легче, чем любое другое соединение) отдает свой электрон свободному радикалу
Отсюда задача – постоянно (ежедневно) обеспечивать организм антиоксидантами, чтобы защититься от многих болячек. В том числе, от онкологии и преждевременного старения.
Теперь становится понятной назначение приставки «анти-» в слове антиоксидант. Эти вещества, подставляя себя, выступают против окисления живых клеток организма свободными радикалами, защищая их.
Теперь давайте определимся, что антиоксиданты из себя представляют. Это целая группа различных химических соединений:
Уважаемые читатели, статья про Антиоксиданты и свободные радикалы завершена.
Старался написать ее понятной для вас. Считаю, что она является хорошим дополнением к предыдущей статье «Основы здорового питания».
До следующей встречи. Здоровья всем!